En el año 2006, la administración de un jarabe contaminado con dietilenglicol (DEG) causó el fallecimiento de 291 personas. El informe describe irregularidades en la cadena de suministro que involucraron a personas, empresas e instituciones en Panamá, España y China
Con información de la OMS
Tras un prolongado proceso judicial, cinco personas fueron condenadas y encarceladas. El intermediario panameño que recibió la glicerina fue declarado culpable de alterar el certificado de análisis y condenado a cinco años de prisión, describe el informe
La Organización Mundial de la Salud (OMS) y la Oficina de las Naciones Unidas contra la Droga y el Delito (UNODC) han publicado conjuntamente un informe histórico que revela hallazgos críticos sobre la amenaza persistente y prevenible de los medicamentos contaminados que se cobraron las vidas y comprometieron la salud de innumerables pacientes, predominantemente niños, a través de la ingestión de medicamentos con niveles peligrosamente altos de sustancias químicas tóxicas.
En los últimos 90 años, al menos 25 incidentes documentados de contaminación de excipientes han causado más de 1300 muertes en todo el mundo, muchas de ellas de niños. Estos incidentes se producen a menudo debido a vulnerabilidades sistémicas en la cadena de suministro global de excipientes farmacéuticos y han afectado de forma desproporcionada a personas en países de ingresos bajos y medianos (PIBM), donde la supervisión regulatoria y el acceso a medicamentos de calidad garantizada pueden ser limitados.
Titulado “ Medicamentos contaminados e integridad de la cadena de suministro de excipientes farmacéuticos ”, el informe destaca una trágica y continua crisis de salud pública: la contaminación de medicamentos con productos químicos tóxicos de grado industrial, en particular dietilenglicol (DEG) y etilenglicol (EG).
Estas sustancias se utilizan como disolventes industriales y anticongelantes, pero pueden causar graves problemas de salud y ser mortales si se ingieren, incluso en pequeñas cantidades, especialmente en niños. Con frecuencia se sustituyen ilegalmente por excipientes de grado farmacéutico como el propilenglicol, la glicerina y el sorbitol, ingredientes utilizados en la formulación de medicamentos, como jarabes para la tos y paracetamol.
Desde octubre de 2022, la OMS ha emitido siete alertas sobre productos médicos relacionadas con múltiples lotes de medicamentos orales líquidos contaminados, muchos de los cuales se comercializaron para uso pediátrico y se exportaron ampliamente a países de ingresos bajos y medios.
La OMS también emitió dos alertas sobre productos químicos a granel falsificados que se hacían pasar por excipientes de calidad farmacéutica.
Tras un caso particularmente grave en Gambia, en el que al menos 66 niños perdieron la vida, la atención volvió a centrarse en este problema. Al caso de Gambia le siguieron rápidamente incidentes similares en Indonesia y Uzbekistán, con otras 268 muertes reportadas y dos alertas adicionales de productos médicos de la OMS.
La mayoría de los casos recientes se refieren a medicamentos líquidos orales de bajo costo que se pueden comprar sin receta. En la mayoría de los casos, estos medicamentos se comercializaron específicamente para niños y son medicamentos registrados disponibles en farmacias, boticas o mercados callejeros informales.
El caso Panamá

En el informe de la OMS figura Panamá con un estudio de caso. En concreto, año 2006, cuando la administración de un jarabe contaminado con dietilenglicol (DEG) causó la muerte de 291 personas (ver página 37).
El resumen de la situación, recuerda que “en julio de 2006, comenzaron a presentarse pacientes en hospitales públicos de Panamá con diversos síntomas, incluyendo Infección Respiratoria Aguda (IRA).
Investigaciones detalladas revelaron que muchos de los pacientes habían estado tomando un medicamento llamado lisinopril, utilizado para tratar la hipertensión arterial y la insuficiencia cardíaca. Inicialmente se pensó que el lisinopril podría ser el responsable, pero posteriormente se identificó que uno de los efectos secundarios comunes del lisinopril es una tos seca con cosquilleo, para la cual se recetaban jarabes para la tos de producción local. Posteriormente, se informó que 291 personas murieron y otras 111 sobrevivieron tras haber ingerido jarabes para la tos contaminados con DEG. Se sospecha que las cifras reales son mayores.
Investigación
La sospecha inicial recayó en el medicamento para la presión arterial recetado a varios de los pacientes afectados.
Las pruebas de laboratorio revelaron que el medicamento cumplía con las especificaciones. Solo cuando se descubrió que un efecto secundario común del medicamento era la tos seca, para la cual se prescribió un medicamento para la tos, la investigación se centró en el medicamento para la tos.
El análisis del medicamento reveló una contaminación con aproximadamente un 8 % de DEG, 80 veces el nivel permitido”.
El informe describe que el medicamento para la tos fue fabricado y distribuido por la CSS.
Una vez se analizan los excipientes utilizados en la producción del medicamento, se obtuvo y analizó la glicerina. “Se encontró que estaba contaminada con un 22 % de DEG, lo que equivale a 220 veces el nivel permitido”.
Investigación de rastreo de la cadena de suministro
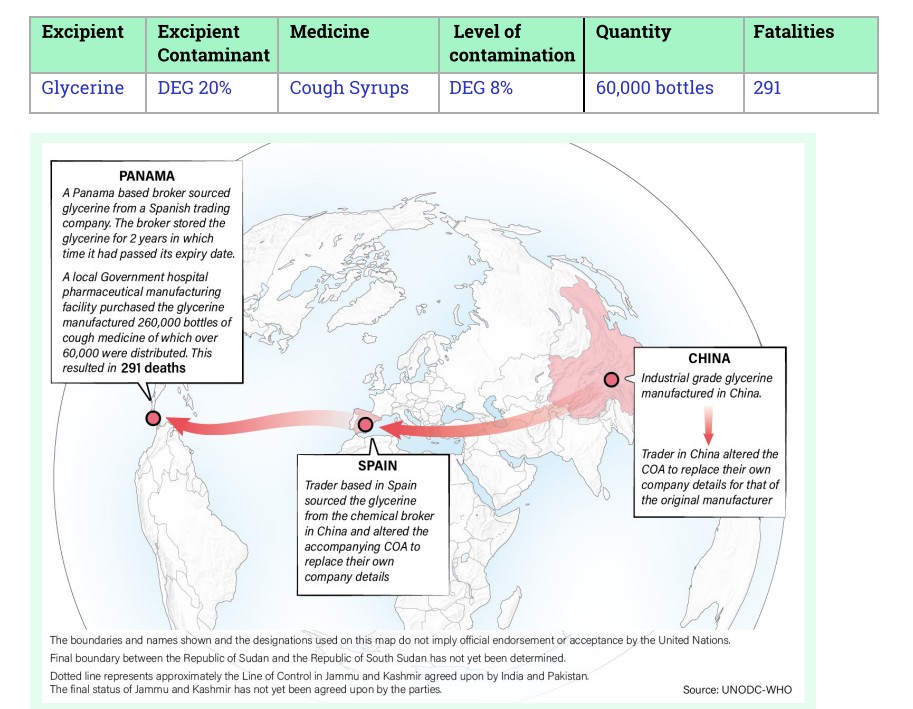
El informe describe cómo ocurrió la cadena de hechos y las fallas en la cadena de suministro:
“Una planta de fabricación de productos farmacéuticos de un hospital público local adquirió 46 bidones de glicerina etiquetados como de grado farmacéutico a un intermediario químico local. Estos bidones se utilizaron para fabricar 260.000 frascos de jarabe para la tos, de los cuales se distribuyeron más de 60.000.
La planta de fabricación no realizó ninguna prueba de identidad ni de impurezas de la glicerina.
El intermediario, con sede en Panamá, obtuvo la glicerina de una empresa comercializadora con sede en España. El intermediario almacenó la glicerina durante dos años, periodo durante el cual había vencido su fecha de caducidad. El intermediario extendió la fecha de caducidad sin realizar ninguna prueba.
El comerciante con sede en España obtuvo la glicerina de un intermediario químico con sede en China. El intermediario español alteró el certificado de autenticidad (COA) adjunto para sustituir los datos de su propia empresa por los del comerciante chino. También declaró que desconocía que la glicerina estuviera destinada al consumo humano.
El comerciante en China obtuvo la glicerina de un fabricante local. El comerciante en China alteró el COA para sustituir los datos de su propia empresa por los del fabricante original.
El fabricante de glicerina en China declaró que solo fabricaba glicerina de grado industrial, no fabricaba glicerina de grado farmacéutico y no estaba autorizado para ello. Sin embargo, el COA que acompañaba a la glicerina declaraba que tenía un nivel de pureza del 99,5 %”.
Acciones
En 2016, tras un prolongado proceso judicial, cinco personas fueron condenadas y encarceladas. El intermediario panameño que recibió la glicerina fue declarado culpable de alterar el certificado de análisis y condenado a cinco años de prisión. El jefe del laboratorio de control de calidad de la Caja de Seguro Social, que autorizó el uso de la glicerina, y el almacenista que también certificó su uso, fueron condenados a 12 meses de prisión. Dos personas que dirigían el órgano administrativo responsable de la supervisión del laboratorio de control de calidad también fueron condenadas a 12 meses de prisión. El intermediario español fue investigado, pero el caso fue desestimado. Panamá remitió a España ante el Tribunal Europeo de Derechos Humanos.
Las autoridades reguladoras sanitarias de China concluyeron que no tenían facultades para procesar al fabricante ni al distribuidor de la glicerina, ya que ninguno de ellos estaba autorizado para fabricar ni comercializar productos farmacéuticos.
Hallazgos clave del informe de la OMS
El informe revela cómo las redes criminales aprovechan la volatilidad del mercado y las lagunas regulatorias para introducir sustitutos tóxicos en la cadena de suministro. Las principales conclusiones incluyen:
- El uso de etiquetas falsificadas y la sustitución de excipientes legítimos por productos químicos tóxicos, como el propilenglicol.
- La comercialización de excipientes falsificados a través de plataformas en línea, incluido el comercio electrónico y las redes sociales.
- Falta de supervisión regulatoria para los fabricantes y distribuidores de excipientes de alto riesgo.
- Deficiencias en los mecanismos de vigilancia y cumplimiento posteriores a la comercialización, tanto en los países fabricantes como en los importadores.
- Conducta delictiva intencional, incluida la falsificación deliberada de excipientes y documentación, que contribuye directamente a múltiples incidentes de contaminación.
- La coordinación y la capacidad inadecuadas entre las autoridades reguladoras, aduaneras y policiales obstaculizan las investigaciones y los procesamientos oportunos en algunas jurisdicciones.
Llamada a la acción
El informe pide una acción mundial urgente para cerrar las brechas regulatorias, fortalecer la supervisión de las cadenas de suministro de excipientes y proteger a todas las poblaciones, especialmente a las más vulnerables, como los niños, de intoxicaciones prevenibles y mortales.
La OMS ha desempeñado durante mucho tiempo un papel central y proactivo en la prevención, detección y respuesta a productos médicos de calidad subestándar y falsificados. Este informe refuerza la importancia crucial de contar con sistemas regulatorios de medicamentos sólidos y eficaces para garantizar el acceso a productos seguros, eficaces y de calidad garantizada.
Como complemento a esta perspectiva de salud pública, la UNODC destaca la dimensión criminal del problema, documentando cómo los grupos delictivos organizados falsifican documentación, sustituyen productos químicos de grado industrial y explotan las plataformas digitales para infiltrarse ilegalmente en la cadena de suministro farmacéutica global con sustancias tóxicas y no reguladas. Su contribución subraya la importancia de las respuestas de la justicia penal en paralelo a la acción regulatoria.
El informe subraya la necesidad de:
- Marcos regulatorios mejorados y mecanismos de cumplimiento.
- Mayor cumplimiento por parte de fabricantes y distribuidores.
- Mayor transparencia y trazabilidad en la cadena de suministro de excipientes.
- Mayor colaboración entre las autoridades sanitarias, las fuerzas del orden y el sector privado.
- Colaboración más estrecha e intercambio oportuno de información entre las autoridades reguladoras, las fuerzas del orden y las aduanas para apoyar las investigaciones y los enjuiciamientos.
- Mayor aplicación de las leyes existentes, incluida la aplicación de sanciones en casos de incumplimiento crítico de las regulaciones relacionadas con excipientes contaminados.
- Mejorar la calidad de las investigaciones y la capacidad procesal para abordar los actos intencionales de contaminación y falsificación de excipientes farmacéuticos.
- Reforzar los mecanismos de vigilancia posterior a la comercialización para detectar y responder a incidentes con posibles dimensiones delictivas.
- Marcos jurídicos y operativos mejorados para abordar la falsificación deliberada de etiquetas, certificados de análisis y composición de excipientes.
En muchos casos, los medicamentos contaminados son resultado de conductas delictivas intencionales. Abordar esta amenaza requiere esfuerzos coordinados de todas las partes interesadas, incluidos los organismos encargados de hacer cumplir la ley, los funcionarios de aduanas, los fiscales y los organismos anticorrupción.
El informe insta a una mayor cooperación transfronteriza, mayor capacidad de investigación y el uso de instrumentos jurídicos internacionales como la Convención de las Naciones Unidas contra la Delincuencia Organizada Transnacional (UNTOC).
La OMS y la UNODC instan a los Estados Miembros, las autoridades reguladoras nacionales, los actores de la justicia penal, los organismos encargados de hacer cumplir la ley, los fabricantes farmacéuticos y los distribuidores de excipientes a tomar medidas decisivas de inmediato para prevenir nuevas tragedias evitables. Si no se actúa ahora, se corre el riesgo de condenar a futuras generaciones de niños a los mismos daños inaceptables y evitables.
Un esfuerzo colaborativo basado en una asociación global
Este informe es el resultado de un esfuerzo conjunto entre las autoridades reguladoras nacionales (ARN) y los socios mundiales en materia de salud. Su elaboración fue posible gracias al generoso apoyo del Fondo Fleming y la Fundación Gates.
La OMS y la ONUDD expresan su sincero agradecimiento a todos los interesados que contribuyeron a esta importante labor, en particular a los organismos reguladores nacionales de Gambia, Indonesia y Pakistán, cuyas experiencias y conocimientos fueron fundamentales para dar forma a las conclusiones del informe.
Lea el informe completo aquí